E.Barrau(1), M. Lagente(2), Y. Barniol(1), M. Stebenet(1), J.P. Thouvenot(1).
Le dosage de la protéine C-réactive (CRP) est actuellement un examen de pratique courante, fréquemment demandé en urgence. Il a été procédé à la comparaison de trois méthodes de dosage de cet analyte, sur trois appareillages largement diffusés: TDX Abbott, BNA Behring et ICS Beckman. Le protocole suivi a été celui défini par la Commission " VALTEC " de la SFBC. Du point de vue répétabilité, les coefficients de variation (CV p. cent) sont inférieurs à 1 0, sauf pour le TDX pour une CRP de 1 6 mg/1 (1 9,3) et l'ICS au niveau de 56,4 mg/1 (1 2,5). La reproductibilité confirme les résultats de la répétabilité pour le TDX, alors que l'ICS a toujours des CV p. cent inférieurs à 1 0. La linéarité dans la gamme testée (0 à 1 33 mg/1) est excellente (r = 0,99) pour les trois appareils. Les appareillages comparés deux à deux sur 104 spécimens de patients montrent des droites d'allométrie et des coefficients de corrélation parfaitement acceptables (r>0,98). Il est à remarquer, un comportement différent des appareils selon que le spécimen analysé est un sérum de contrôle ou un sérum de patient. L'ICS demande une calibration tous les jours et présente les meilleurs résultats d’exactitude pour les sérums de contrôle. Le BNA montre les meilleurs résultats de précision. Le TDX est l'appareil le plus facile à utiliser, mais sa précision dans les concentrations basses en CRP est inacceptable.
MOTS CLÉS : Protéine C - Immunodosage par polarisation de fluorescence - Immunonéphélémétrie.
La protéine C-réactive (CRP) est une protéine témoin de la réaction inflammatoire [1] dont le dosage connaît actuellement un net regain d'intérêt en raison d'une meilleure connaissance de ses propriétés biologiques [2]. La mise au point de techniques de dosages moins longue [3] que l'immunodiffusion radiale permet d'effectuer cet examen en routine voire en urgence, en particulier en pathologie néonatale [4, 5}. L'intérêt du dosage de la CRP réside essentiellement dans la précocité et l'amplitude des variations de sa concentration en réponse à un stimulus inflammatoire qu'elle qu'en soit l'origine. Nous avons voulu comparer trois méthodes actuellement commercialisées :
- Immunodosage par polarisation de fluorescence avec le TDX Abbott ;
- Immunonéphélémétrie par agglutination passive inversée en point final avec l'analyseur néphélémètre Behring (BNA : Behring Nephelometer Analyzer) ;
- Immunonéphélémétrie par précipitation en méthode cinétique avec l'analyseur Beckman (ICS :Immuno Chemistry System).
Le TDX Abbott utilisé est un analyseur automatique basé sur la mesure de la polarisation de fluorescence des complexes antigène-anticorps formés (Fluorescence Polarization Immuno Assay : FPIA).Les réactifs sont prêts à l'emploi et le paramètre analysé reconnu par l'appareil grâce à une identification par code à barres. La gamme de calibration comporte six points : 0, 40, 80, 1 20, 1 80, 260 mg/1. Les contrôles Abbott Low (L) à 30 mg/1 et High (H) à 1 50 mg/1 permettent la vérification de la calibration.
Les spécimens sont analysés sans préparation préalable. Le volume minimum d'échantillon requis est de 75 µl pour une calibration et 50 µl pour un patient ou un contrôle (8 µl sont effectivement pipetés pour un patient et 32 µl pour une calibration).
Le Beckman ICS utilisé est un néphélémètre manuel dont le principe d'utilisation est basé sur la mesure cinétique de l'intensité de la lumière diffusée par des complexes antigène-anticorps. Le réactif anticorps est constitué par un antisérum de chèvre anti-CRP humaine. La calibration est réalisée en un point grâce à un sérum d'origine humaine (Kallestad titrant 56,4 mg/1). Le contrôle de la calibration est effectué grâce à un pool de patients. La mesure est réalisée dans des cuves à usage unique contenant chacune un barreau aimanté pour l'agitation. Les spécimens doivent être préalablement traités : le sérum (100µl) est dilué au 1/6° à l'aide du tampon fourni dans le coffret ; après centrifugation, 1 00 µl de surnageant sont déposés dans la cuvette-agitateur ; 42 µl d'antisérum de chèvre anti-CRP humaine permettent ensuite la réaction d'immunoprécipitation.
L'analyseur BNA utilisé est un néphélémètre automatique. Le principe du dosage de la CRP avec cet appareil, repose sur la mesure de la variation de l'intensité de la lumière diffusée en point final par des complexes antigène-anticorps. Les réactifs comprennent d'une part le " N CRP Latex " constitué par les anticorps anti-CRP fixés sur des particules de latex et d'autre part le " N CRP accélérateur " (polyéthylène glycol). La calibration est effectuée par une procédure multipoints à l'aide du N standard CRP Behring à 1/6 mg/l, à partir duquel l'appareil réalise automatiquement une gamme en sept points. Le contrôle est effectué à l'aide du N sérum de contrôle CRP Behring à 1/5 mg/l et d'un pool de patients.
Les spécimens sont utilisés sans préparation préalable. La technique prévoit l'emploi de 200 µl de sérum (50µl seulement sont pipetés), 40 µl de " N CRP latex " et 10 µl de " N CRP accélérateur ".
Ils sont .constitués par les sérums de contrôle du TDX, les sérums de calibration de l'ICS et du BNA complétés par le sérum de contrôle ATAB Calibrator 7 (ATAB : Atlantic Antibodies). Des pools de sérums ont permis d'obtenir trois niveaux de concentration (élevé :E, moyen :M, bas :B) à l'aide de sérums de patients. Chaque pool est centrifugé à 3 000 g, filtré, réparti ensuite en parties aliquotes dans des récipients stériles et congelé rapidement à - 20'C.
Avant utilisation, il est décongelé à 37 'C. Les spécimens de patients ont été recueillis après centrifugation à 3 000 g de prélèvements effectués sur tube sec. Ils sont analysés le jour même du prélèvement.
Le protocole suivi a été celui défini par la Commission " Validation de Techniques " de la Société Française de Biologie Clinique (SFBC), dans sa partie 11 : Protocole de vérification d'une adaptation [6].
| TDX | ICS | BNA | ||||
| Répétabilité (n = 20) | ||||||
| Spécimens (valeur cible) |
Moyenne | CV % | Moyenne | CV % | Moyenne | CV % |
| Behring N std CRP (16 mg/l) |
14.20 |
19.35 | 16.47 | 5.11 | 18.10 | 2.53 |
| Abbott (L) (30 mg/l) |
27.90 | 6.85 | 24.95 | 3.40 | 28.42 | 3.95 |
| Kallestad (56.4 mg/l) |
47.42 | 5.08 | 57.53 | 12.50 | 52.10 | 4.78 |
| Abbott (H) (150 mg/l) |
158.47 | 2.43 | 164.79 | 6.02 | 133.05 | 10.07 |
| Reproductibilité (n = 10) | ||||||
| Pool bas (8 mg/l) |
5.60 | 35.03 | 9.20 | 9.10 | 8.60 | 5.81 |
| Behring N std CRP (16 mg/l) |
15.30 | 11.69 | 16.60 | 6.74 | 17.00 | 5.09 |
| Pool moyen (29 mg/l) |
27.50 | 9.83 | 26.40 | 6.93 | 34.60 | 4.57 |
| Atab calibrator 7 (123 mg/l) |
89.70 | 2.44 | 122.30 | 4.25 | 113.00 | 8.15 |
| Pool élevé (141 mg/l) |
135.60 | 4.09 | 130.50 | 7.20 | 158.10 | 2.75 |
TABLEAU 1 - Précision comparée des trois appareillages.
L'étude des résultats de la répétabilité effectuée sur une série de 20 mesures montre (tableau I) des coefficients de variation inférieurs à 1 0 p. cent pour le BNA et l'ICS (à l'exception de l'ICS pour la concentration de 56,4 mg/1). Le résultat du TDX pour la concentration de 16 mg/1 (19,35 p. cent) est d'autant plus inacceptable qu'il correspond au seuil de décision généralement admis. La reproductibilité effectuée sur une série de 1 0 mesures (2 mesures par jour pendant 5 jours) sur la séquence suivante : N standard CRP, pool E, pool M, pool B, sérum ATAB Calibrator 7, confirme les résultats de la répétabilité (tableau I). Le TDX, pour des concentrations de 8 et 1 6 mg/1, montre respectivement des coefficients de variation de 35,03 p. cent et 11,69 p. cent, chiffres beaucoup trop élevés. Les deux autres appareillages, quelle que soit la concentration du spécimen, ont des résultats inférieurs à 1 0 p. cent. Des dilutions dans de l'eau distillée de sérums de patients ont permis de tester la linéarité des trois méthodes dans la zone de 8,30 à 1 33 mg/1. L'absence d'une quantité suffisante de sérum de concentration en CRP supérieur à 1 33 mg/1 ne nous a pas permis de tester la linéarité dans une gamme plus large. Dans la zone étudiée, chacun des appareillages présente un coefficient de corrélation linéaire égal à 0,99. La corrélation a été effectuée sur 6 dilutions entre les valeurs théoriques et la moyenne pour chaque concentration de 6 mesures effectuées sur 2 jours consécutifs.
Pour la comparaison des sérums de patients, 104 spécimens ont été dosés sur les trois appareils. En l'absence de technique de référence, les appareillages ont été comparés deux à deux (BNA/ICS ; TDX/ ICS ; BNA/TDX).
Fig. 1. - Comparaison des
trois appareils par la méthode de la droite d'allométrie.
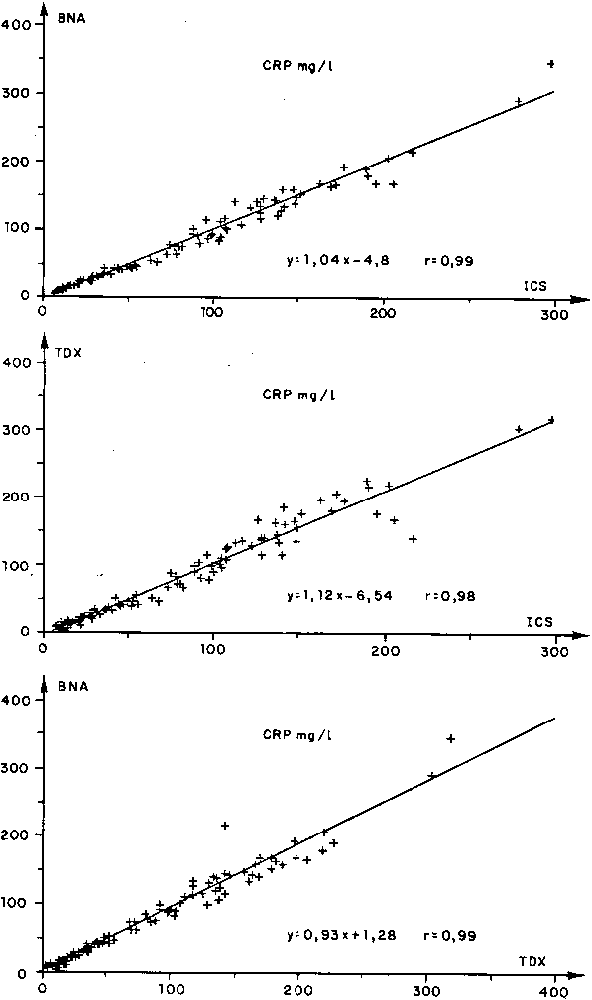
La figure 1 présente la répartition des spécimens par rapport à l'équation des droites d'allométrie. L'interprétation de celle-ci permet de dire que le BNA et le TDX donnent des résultats plus bas que l'ICS, respectivement jusqu'à une concentration en CRP de 1 23 et 55 mg/1 ; par contre le BNA et le TDX présentent des résultats équivalents jusqu'à une concentration en CRP de 18 mg/1, au-delà le BNA présentera des résultats plus bas. Dans le but de comparer les résultats de chaque appareillage par rapport aux deux autres, nous avons présenté (fig. 2) sur un axe la position des résultats de chaque méthodologie.
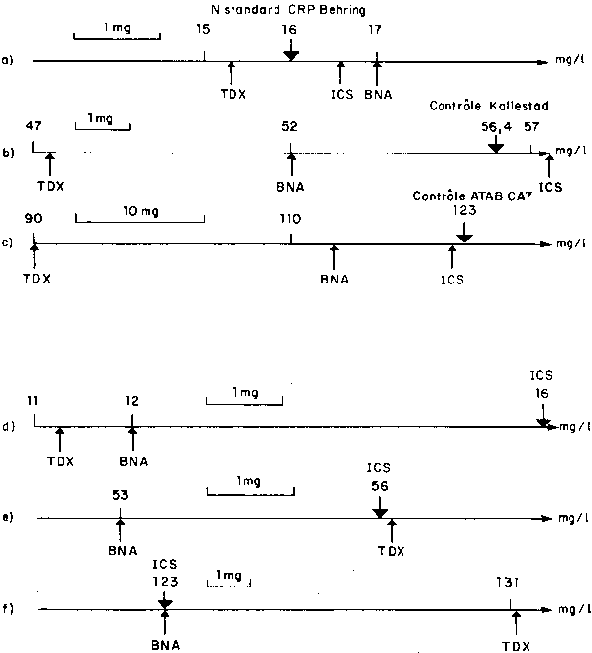
Fig.2.-Situation relative des résultats des trois appareils pour deux sérums de calibration(a,b",un sérum de contrôle(c)et pour les niveaux de même concentration(d,e,f)de sérums de patients. Pour les axes(a,b,c),les résultats utilisés sont les moyennes issues de la répétabilité ou de la reproductibilité. Pour les axes(d,e,f),les droites d'allométrie ont permis de recalculer les positions du TDX et du BNA par rapport à la position de l'ICS prise comme référence, cette dernière technique s'étant montrée la plus exacte pour les contrôles.
Le TDX Abbott montre une imprécision beaucoup trop importante et inacceptable pour des concentrations en CRP inférieures à 1 6 mg/1. Ces résultats sont en accord avec ceux déjà publiés par Buitrago et coll. [7] qui trouvent un coefficient de variation de 18,9 p. cent effectué lors d’une épreuve de répétabilité à l'aide d'un pool de sérum inférieur à 1 0 mg/1.Benattar et coll. [8] situent la limite de détection de cet appareillage à 1 0 mg/1, ce qui confirme nos mauvais résultats obtenus avec un pool à 8 mg/1 : coefficient de variation égal à 35,03 p. cent. Cette imprécision peut sans doute être améliorée par l'augmentation de la prise d'essai au détriment de la plage de la linéarité. Les " rapports de l'évaluation sur la protéine C-réactive (TDX) " [9] montrent des résultats de précision comparables aux nôtres pour des concentrations en CRP identiques, cependant il n'a pas été testé de concentration très basse. Le BNA Behring et l'ICS Beckman présentent des résultats de précision plus homogènes. Les bons coefficients de variation au niveau des concentrations basses font du BNA la machine la plus fiable au niveau du seuil de décision généralement admis. Toutefois, il faut remarquer pour le BNA l'augmentation du coefficient de variation avec la concentration de la CRP, alors qu'il est habituel que le coefficient de variation diminue quand la concentration de l'analyte augmente. Cette anomalie n'est vraisemblablement pas explicable par un phénomène de contamination car les différents niveaux ont été analysés indépendamment mais probablement par la composition chimique du contrôle Abbott à 1 50 mg/1. Cette anomalie du BNA Behring concernant le test de répétabilité n'a pas été retrouvée dans le cadre de la reproductibilité avec un pool de sérums de patients et le contrôle ATAB Calibrator 7. Bien que les spécimens soient préparés manuellement, l'ICS présente dans l'ensemble une bonne précision. Nos résultats sont acceptables mais toutefois moins bons que ceux donnés par Gill et coll. [10]. Par ailleurs, l'ICS s'est montré la machine la plus exacte pour les résultats des contrôles.
L'épreuve de linéarité a montré des résultats excellents pour les trois appareils dans la gamme testée qui représente la majorité des valeurs rencontrées dans @es sérums de patients.
Le bon pourcentage d'exactitude des résultats obtenus avec l'ICS Beckman par rapport aux valeurs cibles des contrôles, peut s'expliquer par une calibration obligatoire avant chaque série qui n'existe pas avec les deux autres appareils, soumis simplement à un contrôle apprécié par l'utilisateur et non pas automatiquement par l'appareil. La calibration du BNA et du TDX est faite d'une manière moins fréquente (bimensuel et trimestriel en moyenne). Les trois appareils se comportent différemment selon la nature du spécimen analysé : sérum de contrôle ou sérum de patient (fig. 2). Si le TDX montre pour des contrôles des résultats systématiquement plus bas que les deux autres méthodes, il n'en est pas de même pour les sérums de patients où les résultats sont plus bas pour des concentrations basses et plus hauts pour des concentrations élevées.
La comparaison du dosage de la CRP par trois méthodes différentes utilisant l'immunodosage par polarisation de fluorescence (TDX), l'immunonéphélémétrie par précipitation en milieu liquide (ICS), l'immunonéphélémétrie par agglutination passive inversée (BNA) permet de mettre en évidence les caractéristiques suivantes :
- le BNA est l'appareil le plus précis,
- l'ICS est l'appareil le plus exact,
- le TDX est le plus facile à utiliser, mais sa précision dans des concentrations correspondant au seuil de décision généralement admis est insuffisante. Une amélioration de la technique nous semble indispensable.
En tout état de cause, les trois appareils testés, restent plus simples, plus faciles, plus rapides en comparaison de la technique d'immunodiffusion radiale utilisée auparavant. De plus l'ensemble du matériel étudié donne des résultats acceptables tant du point de vue précision (sauf pour le TDX dans les valeurs basses) qu'au point de vue de l'exactitude.
1 . Bienvenu J. - Les protéines de la réaction inflammatoire : définition, physiologie et méthodes de dosage. Afln. @io/. c/in., 1984, 42, 47.
2 Engler R. - Protéines de la réaction inflammatoire. Fonctions régulatrices. Ann. Biol. Clin., 1988, 46, 336.
3. Merlini G., Pavesi F., Bergonzi C., Belloti V., Zorgoli L., Vadacca G.,Aguzzi L., Moratti R. - Immunoassay methods for determination of serum C-reactive protein levels. Ric. Clin. Lab., 1984, 41, 581.
4. Magny J.F., Benattar C. - C-réactive protéine et infection néonatale. intérêt diagnostique. Arch. fr. Ped., 1984, 47, 167.
5. TherondP.,BiouD.,DemelierJ.F.-Application clinique des dosages de la protéine C-réactive et de l'orosomucoïde en pédiatrie. Pharm. Biol., 1986, 161, 39.
6. Commission"Validation de Techniques",Protocole de validation de technique (Document B, Stade 3). Ann. Biol. Clin., 1986, 44, 686.
7. BuitagroG.,CavaF.,GomezDelCampoA.,MoyanoJ.C.,NavajoJ.A.- Clinical evaluation of a fluorescence polarization immunoassay for quantifying C-reactive protein. Clin. Chem., 1988, 3, 5951
8. Benattar C., Francoual J., Magny J.F., Lindenbaum A. - Evaluation d'une méthode rapide d'immunodosage de la protéine C-réactive par polarisation de fluorescence. Ann. Biol. Clin., 1989, 47, 181.
9 Rapport d'évaluation sur la protéine C-réactive (TDX) : Monsieur Lindenbaumn, Laboratoire de Biochimie, Centre Hospitalier Lyon Sud, 69 PIERRE-BÉNITE.
10. GillCW.,BushS.W.,BurleighW.M.,FischerC.L.-An evaluation of a C-reactive protein assay using a rate immunonephelemetric procedure. Am. J. Clin. Pathol., 1981, 1, 50.
(1)
Laboratoire de Biochimie (Professeur J.P. Thouvenot)
CHU de Purpan
31052 TOULOUSE CEDEX
(2)
Laboratoire de Biochimie (Professeur P. Valdiguié)
CHU de angueil
31054 TOULOUSE CEDEX